영: Orbital - Probable location of finding electron somewhere within an atom
한: 원자내에서 전자가 발견될 수 있는 위치이다. 반대로 말하면 Orbital 안이 아닌 위치에서는 전자가 발견될 수 없다는 말.
Orbital은 종류가 s, p, d, f. 이렇게 네가지 있는데 오늘은 s orbital과 p orbital에 집중을 해보도록 하겠다.
s orbital:
1. 구 형태의 orbital. 구의 정가운데에 원자핵이 위치함.
2. 1s, 2s, 3s... 로 여러개의 orbital이 공존 가능한데 이들의 차이는 원자핵과의 거리이다. 1s<2s<3s... 순으로 원자핵과 멀어진다.

p orbital:
1. s orbital과 다르게 3가지 종류로서 존재 (이 3가지가 세트로 1p). px orbital은 x축에 놓이고, py orbital은 y축, pz orbital은 z축.
2. s orbital과 마찬가지로 원자핵과의 거리 1p<2p<3p... 순.

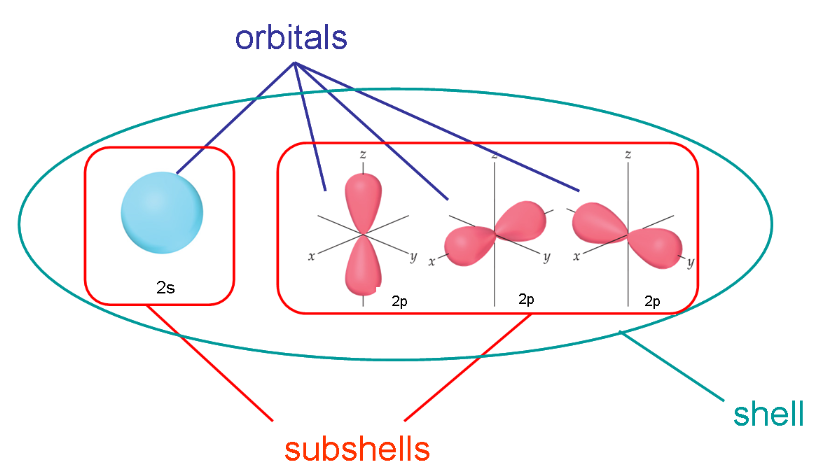
Shell> Subshells> Orbitals
Shell은 2s나 2p같이 앞의 숫자가 같으면 같은 shell로 간주한다.
Subshell이 같으려면 숫자는 물론 알파벳까지 일치해야 한다. 2s와 2p는 다른 subshell.
Subshell과 orbital의 차이를 이해하려면 p orbital을 봐야하는데 2px와 2py는 같은 subshell이지만 다른 orbital이다.
p subshell에는 3개의 서로 다른 orbitals가 존재한다.
다음 개념은 electron configuration (전자배열)이다.
영: electron configuration- the arrangement of electrons in orbitals around an atomic nucleus
한: 전자배열- 전자가 원자핵을 중심으로 오비탈에 배열되는 방식.
전자들은 orbital에 마구잡이로 들어가는게 아니라 특정한 규칙을 가지고 orbital에 배열된다. 지금부터 그 규칙을 알아보도록 하겠다.
1. Orbital 1개당 2개의 전자가 들어갈 수 있다.
- 따라서 s orbital에는 2개의 전자가 들어갈 수 있다.
- 허나 위에서 보았듯이 p orbital은 3가지 종류로서 존재한다. 따라서 2x3=6. p subshell에는 전자가 6개 들어갈 수 있다.
* 자세히 다루진 않겠지만 d subshell과 f subshell에는 각각 10개와 14개의 전자가 들어갈 수 있다.
2. Madelung's rule
1s<2s<2p<3s<3p<4s<3d<4p<5s...
에너지 레벨은 다음과 같은 순서로 점점 높아진다. 따라서 가장 낮은 에너지 레벨인 orbital부터 차례대로 전자가 채워진다.

*세번째 규칙은 Carbon (탄소) electron configuration (전자배열)을 예시로 들어 설명하겠다.
에너지 레벨이 가장 낮은 orbital 부터 전자가 채워지는 걸 볼 수 있다. 탄소의 원자번호는 6. 따라서 전자는 6개. 가장 낮은 에너지 레벨인 1s orbital부터 2개, 2s 2개, 2p orbital도 2개가 채워지는데 여기서 우리가 주목해야 할 orbital은 2p이다. 2p subshell의 경우 3개의 orbital이 있다. px, py, pz. 허나 이 경우 전자는 p orbital 중 하나에만 2개 들어가지 않는다. 그러니까 px orbital에 전자가 2개 들어가는 게 아닌 px orbital과 py orbital에 하나씩 들어간다는 말이다.

왜 이런 현상이 일어날까?
-그 이유는 전자는 서로를 밀어내려고 하기 때문에 가능한 서로 먼 위치에 배치되게 된다. 같은 p orbital에 배치되는 것보단 다른 p orbital에 배치되는 것이 저항이 덜 하므로 이런 현상이 발생한다. 2p orbital에 전자가 4개 채워져야 할 경우, 그제서야 한 orbital에 2개의 전자가 배치되게 된다.
봐주셔서 감사합니다.
'화학 Chemistry' 카테고리의 다른 글
| Cycloalkane의 입체화학에 대해 알아보자 (0) | 2023.08.24 |
|---|---|
| Alkane의 입체화학에 대해 알아보자 (0) | 2023.08.23 |
| Organic compound에서 Substituent 찾기 (0) | 2023.08.22 |
| Aromatic, Antiaromatic, Nonaromatic의 비교 (0) | 2023.08.21 |
| Orbital hybridization이란? (0) | 2023.08.21 |



