Isomers (이성질체):
똑같은 Molecular formula (분자식), 그러므로 원자의 개수와 각각의 원자 타입이 같음.
허나 분자 안에서의 원자의 배열 방식이 다름.

차례대로 보도록 하자.
Isomer은 우선 Constitutional/structural isomer (구조 이성질체)와 Stereoisomer (입체 이성질체)로 나뉜다.
Constitutional/Structural isomer (구조 이성질체):
분자식은 동일하지만, 원자 사이의 결합의 관계가 다름.
Constitutional/Structural isomer은 또한 Chain isomer (사슬형 이성질체), Functional isomer (작용기 이성질체), 과 Positional isomer (위치 이성질체) 로 나뉠 수 있다.
Chain isomer (사슬형 이성질체):
주사슬의 길이가 다를 때
e.g)

Functional isomer (작용기 이성질체):
서로 다른 작용기일 때
e.g) 알코올과 에테르

Positional isomer (위치 이성질체):
작용기는 같지만 작용기의 위치가 다를 때
e.g)

다음은 Stereoisomer (입체 이성질체)를 자세히 봐보자.
Stereoisomer (입체 이성질체):
분자식 및 구성원자의 연결 방법도 같으나 원자 사이의 공간적 배치가 다르다.
Stereoisomer (입체 이성질체)는 Configurational isomer (배위/배열 이성질체) 과 Conformational isomer (형태 이성질체)로 나뉠 수 있다.
Conformational isomer (형태 이성질체):
원자 혹은 원자단을 회전시켜서 같은 구조를 만들 수 있는 이성질체
e.g)

이 예시를 보면 단일 결합을 기준으로 회전시키면 Eclipsed formation에서 Gauche formation으로 구조를 바꿀 수 있다.
Configurational isomer (배위/배열 이성질체):
Conformational isomer의 반대라고 생각하면 된다. 원자 혹은 원자단을 회전시켜서 같은 구조를 만들 수 없는 이성질체
Configurational isomer (배위/배열 이성질체)는 또 Geometric isomer (기하 이성질체)과 Optical isomer (거울상 이성질체) 로 나뉠 수 있다.
Geometric isomer (기하 이성질체)는 Cis/Trans isomer (시스/트랜스 이성질체) 또는 Diastereomer (부분입체 이성질체)인데 사실상 Diastereomer가 Cis/Trans isomer이다.
다음을 보며 이게 무슨 말인지 설명하도록 하겠다.
Cis-trans isomer (시스-트랜스 이성질체):
e.g)

1번의 경우 Cl이 양쪽 모두 위쪽에 위치하여 있다.
이런 Geometric isomer를 Cis isomer (시스 이성질체) 라고 부른다.
2번의 경우 Cl이 한 쪽 탄소에는 위쪽, 다른 쪽 탄소에는 아래쪽에 위치해 있다.
이런 경우를 Trans isomer (트랜스 이성질체)라고 부른다.
3번의 경우는 한 쪽의 탄소에는 오직 2개의 H만이, 다른 쪽 탄소에는 2개의 Cl만이 붙어있다.
이런 경우 3번은 1번, 2번과는 구조식 자체가 달라지게 된다.
탄소에 붙어있는 원자의 조합이 다르기 때문이다.
따라서 3번은 Geometric isomer이 아닌 Constitutional isomer이게 된다.

이 경우를 보도록 하자.
한 탄소는 위쪽에 H가 달려있고, 다른 쪽은 아래에 H가 달려있다.
따라서 Trans.
**이 때 CH3와 C2H5는 고려 대상이 아니다.
원자단이 같을 때만 Cis Trans로 나눌 수 있다.

Imine (이민)의 경우를 보자.
Lone electron pair (고립전자쌍) 역시도 같은 맥락으로 생각하면 된다.
왼쪽의 경우 메틸기가 2개 모두 위쪽에 위치해 있어 Cis.
오른쪽의 경우 한쪽은 위, 나머지는 아래. 따라서 Trans.
Optical isomer/Enantiomer (광학 이성질체/거울상 이성질체):
다음과 같이 사이에 거울을 놓았다고 가정했을 때 거울상이 서로 겹쳐지지 않는 화합물.
따라서 탄소가 4개의 서로 다른 원자/원자단과 결합을 이루고 있어야 한다.
이 탄소를 Chiral carbon (중심탄소/키랄 탄소)라고 부른다.
아래와 같이 화합물끼리 완벽한 대칭 (데칼코마니)을 이룬다.

*광학 이성질체/ 거울상 이성질체의 특징을 알아보자.
- Plane polarized light (편광)에 대하여 서로 반대 방향으로 적용한다.


[a]의 경우 Concentration (농도)나 Path length에 영향을 받지 않는 화합물의 고유한 상수이다.
a가 실제 회전률.
*이 때 편광이 오른쪽으로 돌면 (+), 왼쪽으로 돌면 (-)인데, + 광학 이성질체와 -광학 이성질체의 Mix가 같을 경우 Optically inactive mixture (광학적으로 비활성)인 Racemic mixture (라세미 혼합물)가 나오게 된다.
Racemic mixture의 a= 0도
Diastereomer (부분입체 이성질체):
입체 중심 (키랄탄소)를 여러 개 가지고 있는 화합물 중에서 거울상이 아닌 이성질체를 총칭하여 말한다
이건 무슨 말일까?
다음 예시를 보도록 하자.
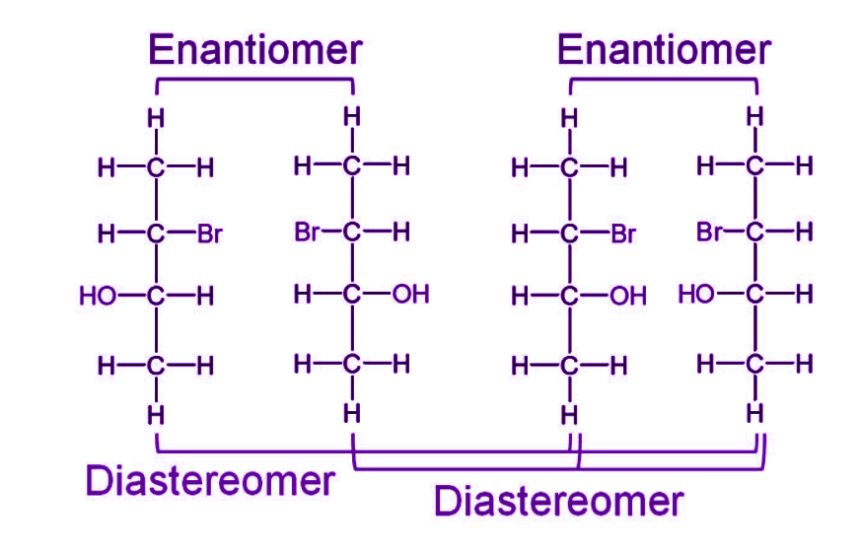
다음 화합물을 보면 위에서부터 2번째, 3번째 탄소와 결합되어 있는 원자 혹은 원자단이 모두 다르다는 것을 확인할 수 있다.
따라서 2번 탄소와 3번 탄소는 Chiral carbon.
이 때 입체 이성질체가 발생할 수 있다.
1번과 2번을 비교해 보자.
1번과 2번 사이에 거울을 놔둔다고 가정하면 데칼코마니처럼 완벽한 대칭이 나온다.
3번과 4번도 마찬가지이다.
따라서 1번과 2번, 3번과 4번은 서로 Enantiomer (거울상 이성질체)
허나 1번과 3번을 비교할 경우, 3번 탄소는 거울상이지만 2번 탄소는 그렇지 않다.
1번과 4번을 비교하면, 2번 탄소는 거울상이지만 3번 탄소는 그렇지 않다.
이 같은 경우를 Diastereomer (부분입체 이성질체)라고 한다.
*Enantiomer가 아닌 Stereoisomer을 Diastereomer라고 인식하면 된다.
Cis/Trans isomer 또한 실은 Diastereomer.

다시 한번 이 예시를 보자.
1번은 Cis isomer.
2번은 Trans isomer.
이 둘 사이의 거울이 있다고 가정해 보자.
Cl과 H의 위치 때문에 이들이 거울상이 아니란 걸 알 수 있다.
따라서 Cis/Trans isomer 또한 Diastereomer (부분입체 이성질체)라는 것.
Enantiomer과 Diastereomer의 차이점은 무엇일까.
Enantiomer끼리는 Physical property (물리적 특성)이 모두 동일하다.
e.g) 녹는점, 끓는점, 밀도 등등
허나 Geometric isomer (Diastereomer)끼리의 경우 물리적 특성이 서로 다르다.
마지막으로 왜 Stereoisomer (입체 이성질체)끼리 Biological activity (생물학적 반응)가 다른지 알아보자.
먼저 알아야 할 것은 R/S configuration (R/S 배열)과 L/D configuration (L/D 배열)이 무엇인지와 그들의 차이이다.
R/S configuration (R/S 배열) :
아래와 같이 Chiral carbon (키랄 탄소)를 기준으로 Priority (우선순위)를 매긴다. 가장 Priority가 낮은 원소/원소단이 Dash (점선)으로 이어져 있을 경우에 우선순위가 시계방향으로 이어진다면 R configuration.

반대로 이번에도 Priority가 가장 낮은 원소/원사단이 점선으로 이어져 있다 치고, 이번에는 반시계방향으로 이어진다면 S configuration.

*이 때 Priority가 가장 낮은 원자단이 점선으로 이어져 있지 않다면 R일 경우 반대인 S이고, S일 경우 반대인 R이다.
L/D configuration (L/D 배열):
L/D configuration은 R/S 명명법이 쓰이기 이전부터 쓰이던 규칙인데, Glyceraldehyde (글리세르알데하이드) 를 기준으로 만들었기 때문에 Sugar (당)과 Amino acid (아미노산)에만 주로 쓰인다. 가장 Priority가 높은 원자/원자단이 우측에 위치에 있을 경우 D configuration이라고 불린다.

가장 높은 Priority가 왼쪽에 위치에 있다면 L configuration이라고 불린다.

*아래그림은 Glyceraldehyde (글리세르알데하이드) 를 보여주고 있다. Chiral carbon (키랄 탄소)가 여러개인데 이럴경우 가장 마지막 Chiral carbon을 기준으로 L과 D를 나눈다.

*참고로 인간의 Amino acid (아미노산/프로틴)은 오직 L-form 만을 가지고 있다.

이제 이 그림을 보자.
두 Amino acid (아미노산)은 Enantiomer (거울상 이성질체)로 회전으로써 서로가 될 수 없다.
이 Amino acid는 Receptor (수용체)에 붙어야지 생물학적 반응을 할 수 있는데 R enantiomer는 3개의 Receptor에 모두 붙을 수 있는 반면에 S enantiomer은 하나밖에 못 붙는다는 사실을 알 수 있다.
S enantiomer은 R enantiomer가 될 수 없으므로 R enantiomer가 S enantiomer보다 훨씬 효과적이다는 것을 알 수 있다. 따라서 Stereoisomer끼리 Biological activity가 다르다.
'화학 Chemistry' 카테고리의 다른 글
| Cycloalkane의 입체화학에 대해 알아보자 (0) | 2023.08.24 |
|---|---|
| Alkane의 입체화학에 대해 알아보자 (0) | 2023.08.23 |
| Organic compound에서 Substituent 찾기 (0) | 2023.08.22 |
| Aromatic, Antiaromatic, Nonaromatic의 비교 (0) | 2023.08.21 |
| Orbital hybridization이란? (0) | 2023.08.21 |



